Calculadora de pH
Con esta calculadora de pH, puedes determinar el pH de una solución de varias formas. Puedes convertir pH a H+, así como calcular el pH a partir de la constante de ionización y la concentración. El valor del pH es un factor esencial en la química, la medicina y la vida cotidiana. Lee el texto a continuación para descubrir qué es la escala de pH y la fórmula del pH. Al final, también te diremos cómo calcular el pH con una sencilla solución paso a paso.
Es posible que nuestra calculadora te pida la concentración de la solución. Si no la conoces, puedes calcularla con nuestra calculadora de concentración. También puedes utilizar la calculadora de dilución de soluciones 🇺🇸 para obtener la concentración de iones de una solución diluida.
Cómo utilizar la calculadora de pH
Una calculadora de pH es una herramienta educativa inestimable, que ayuda tanto a estudiantes como a profesores. Así que vamos a sumergirnos y ver cómo esta calculadora de pH puede simplificarte la vida en unos sencillos pasos.
Lo primero que debes decidir es cómo calcular el pH. Cubriremos los pasos que implica cada opción:
A partir de la concentración de un ácido:
-
Se te proporciona una lista de algunos ácidos comunes. Elige uno de ellos.
-
A continuación, introduce la concentración en unidades molares.
-
La herramienta determinará inmediatamente el PH y la concentración de iones de hidrógeno.
-
Si no encuentras tu ácido en la lista de opciones, elige Personalizado.
- Ahora tienes que introducir el valor de la constante de disociación ácida (Ka) de tu ácido junto con la concentración.
-
La herramienta calculará los valores de pH y H+ a partir de la información proporcionada.
A partir de la concentración de una base:
-
El cálculo del pH de una base es el mismo que para el ácido mencionado anteriormente.
-
La única diferencia es que cuando no encuentres la base de tu elección en la lista de opciones y elijas introducir una base personalizada, introducirás la constante de disociación ácida (Kb) de una base en lugar de Ka.
-
La herramienta determinará al instante los valores de pH y H+.
A partir de la masa y el volumen de un ácido:
-
Elige el ácido que más te guste de la lista de 22 ácidos comunes.
-
Introduce el peso del compuesto sólido. La unidad por defecto es gramos, pero puedes seleccionar otra unidad de masa de la lista según tus necesidades. (Asegúrate de cambiar la unidad antes de introducir el valor; de lo contrario, sólo cambiará tu entrada a la unidad seleccionada posteriormente).
-
Por último, introduce el volumen total de la solución.
-
El resultado se muestra como pH y H+.
-
También tienes la opción de elegir personalizar si tu ácido no está en la lista.
- En tal caso, se requiere además la constante de disociación ácida Ka.
-
El pH y el H+ se calculan a partir de la información proporcionada.
A partir de la masa y el volumen de una base:
- En esta situación, el cálculo del pH para la base es el mismo que para el ácido, como se ha mencionado anteriormente.
- La única excepción es que todos los datos que introduzcas serían para tu base requerida.
A partir de la concentración de iones:
-
el pH puede calcularse a partir de la concentración de iones utilizando cualquiera de las tres variables.
a. Concentración de iones de hidrógeno [H+];
b. Valor del pH; y
c. Concentración de iones de hidróxido [OH-]. -
Puedes introducir cualquiera de ellos, y se calcularán los restantes, junto con el resultado: el valor de pH.
Para los cuatro primeros métodos, haz clic en la sección números relacionados para mostrar el valor pOH, la concentración de iones de hidróxido [OH-] y el pKa.
La escala de pH
La escala de pH es una escala numérica utilizada para definir el grado de acidez o basicidad de una solución acuosa. Normalmente, oscila entre 0 y 14, pero puede ir más allá de estos valores si la solución es lo suficientemente ácida/básica. El valor del pH es logarítmico y está inversamente relacionado con la concentración de iones de hidrógeno en una solución. La fórmula pH a H+ que representa esta relación es:
La solución es ácida si su pH es inferior a 7. Si el pH es superior, la solución es básica (también denominada alcalina). Las soluciones con un pH igual a 7 son neutras.
Además de la forma matemática de determinar el pH, también se pueden utilizar indicadores de pH. La prueba de pH más común es la de papel tornasol. Este cambia de color según el pH de la solución en la que se ha sumergido. Estos colores a menudo inspiran escalas de pH coloridas:
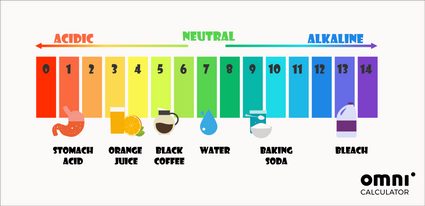
El pH de nuestro cuerpo es casi neutro. Por ejemplo, el pH de la sangre se sitúa en torno a 7.4. La única excepción es el estómago, donde los ácidos gástricos pueden alcanzar incluso un pH de 1.
Las moléculas pueden tener un pH en el que no tengan carga negativa. Esto es lo que determina nuestra calculadora del punto isoeléctrico 🇺🇸.
Definiciones de ácido y de base
Tres teorías diferentes definen el ácido y la base:
- Según la teoría de Arrhenius, en una solución acuosa, un ácido es una sustancia capaz de donar iones de hidrógeno, mientras que una base dona iones de hidróxido.
- La teoría de Brønsted-Lowry afirma que un ácido puede donar protones, mientras que una base puede aceptarlos.
- La teoría de Lewis afirma que un ácido es algo que puede aceptar pares de electrones. Análogamente, una base dona pares de electrones.
Cuanto mayor sea la concentración de iones de hidrógeno procedentes de moléculas ácidas, menor será el pH de la solución y, en consecuencia, mayor será su acidez. Lo contrario ocurre con los iones de hidróxido y las bases. Cuanto mayor es la concentración de iones de hidróxido procedentes de moléculas de bases, mayor es el pH de la solución y, en consecuencia, mayor es su basicidad.
Podemos describir la reacción de un ácido, , en agua como:
con la constante de ionización ácida:
Una reacción química similar entre la base y el agua tiene la siguiente forma:
La siguiente ecuación da la constante de ionización de la base para la fórmula anterior:
Si quieres profundizar en el conocimiento de las constantes de equilibrio químico, consulta la calculadora de constantes de equilibrio o la calculadora de cociente de reacción 🇺🇸.
Cómo calcular el pH – fórmula del pH
El pH se define como el negativo del logaritmo en base diez de la concentración molar de iones de hidrógeno presentes en la solución. La unidad que se emplea para expresar la concentración de iones de hidrógeno es moles por litro. Para determinar el pH, puedes utilizar esta fórmula de pH a H+:
Si ya conoces el pH, pero quieres calcular la concentración de iones, utiliza esta ecuación modificada del pH:
También existe una escala pOH, que es menos popular que la escala de pH. El pOH es el negativo del logaritmo de la concentración de iones de hidróxido:
o:
El pH y el pOH se relacionan entre sí mediante esta ecuación de pOH y pH:
¿Cómo calcular el pH? – solución paso a paso
Estos son los pasos para calcular el pH de una solución:
-
Supongamos que la concentración de iones de hidrógeno es igual a 0.0001 mol/L.
-
Calcula el pH utilizando la fórmula de pH a H+:
- Ahora, también puedes determinar fácilmente el pOH y una concentración de iones hidróxido utilizando las fórmulas:
Por supuesto, ¡no tienes que realizar todos estos cálculos a mano! Elige la opción para determinar el pH con la concentración de iones en la calculadora e introduce cualquiera de estos cuatro valores. ¡Observa cómo la herramienta hace todo el trabajo por ti!
- También puedes buscar una sustancia química en las listas (de ácidos o bases). Digamos que quieres saber cómo encontrar el pH del ácido fórmico . Su es .
- Elige la concentración de la sustancia química. Supongamos que es igual a .
- Para hallar la concentración de iones H+:
donde:
Aquí es la concentración molar de la disolución, y es igual a la concentración molar de H+.
Para :
Ahora ya sabes cómo calcular el pH utilizando las ecuaciones del pH. Si estos cálculos te llevan mucho tiempo, no dudes en recurrir a nuestra calculadora de pH. Selecciona el producto químico y su concentración, y verás cómo hace todo el trabajo por ti.
La mente detrás de la calculadora de pH
Los bioquímicos, los científicos medioambientales y los científicos de materiales necesitan con frecuencia calcular o ajustar los valores de pH para sus investigaciones. Al darme cuenta de esta necesidad, pensé que una calculadora de pH agilizaría estos procesos, permitiendo una experimentación eficaz.
Soy Julia Żuławińska, el cerebro detrás de esta eficiente calculadora de pH, y destaco como figura ejemplar en la comunidad científica, especialmente dentro de la Biofísica y la Biotecnología Molecular. Mi trabajo encarna una intersección entre ciencia y sostenibilidad, lo que subraya significativamente mi papel como investigadora con visión de futuro, preparada para contribuir a la conservación ecológica y a la innovación biotecnológica.
Es posible determinar las fuentes de contaminación y la salud de los ecosistemas controlando el pH de las masas de agua naturales. Los científicos medioambientales podrían utilizar calculadoras de pH para evaluar la calidad del agua al instante.
Nos aseguramos de que nuestras herramientas se basen en información auténtica y en una investigación adecuada. Después de que un experto elabore la calculadora, otro experto en la materia la revisa a fondo. A continuación, un hablante nativo corrige el contenido, garantizando un mayor perfeccionamiento; sólo entonces se publica la herramienta para nuestros usuarios. Para saber más sobre nuestro compromiso con la calidad, consulta nuestra .
¿Qué es el pH?
El pH mide la concentración de iones de hidrógeno positivos en una solución. Esta cantidad está correlacionada con la acidez de una solución: cuanto mayor sea la concentración de iones de hidrógeno, menor será su pH. Dicha correlación se deriva de la tendencia de una sustancia ácida a provocar la disociación del agua: a mayor disociación, mayor acidez.
¿Cómo se calcula el pH de una solución?
Para calcular el pH de una solución:
-
Mide la concentración de iones de hidrógeno en la solución. Alternativamente, se puede medir la actividad de la misma especie. Podemos llamarla
[H+]. -
Calcula el logaritmo en base 10 de esta cantidad:
log10([H+]). -
Obtén el inverso aditivo de esta cantidad. El pH viene dado por:
pH = - log10([H+])
¿Cuál es la diferencia entre pH y pOH?
El pOH es una medida similar al pH y se correlaciona con la concentración de iones de hidróxido en una solución. La fórmula para el pOH es:
pOH = -log10([OH-])
En condiciones específicas (soluciones acuosas a temperatura ambiente), podemos definir una relación útil entre pH y pOH:
pH = 14 - pOH
¿Cuáles son algunos ejemplos de pH?
He aquí algunos ejemplos de pH:
-
El pH del agua pura es
7, que es el punto medio de la escala de pH. -
El pH de nuestro estómago varía de
1.5a3.5: ¡nuestro estómago es bastante ácido! -
El ácido de batería de tu automóvil tiene un pH de aproximadamente
0.5. ¡No metas las manos ahí! -
Los productos domésticos como los limpiadores de desagües son bases fuertes: ¡algunos pueden alcanzar un pH de
14!