Calculateur de pH
Grâce à ce calculateur de pH, on peut déterminer le pH d'une solution de plusieurs manières. Il peut convertir le pH en H+, ainsi que calculer le pH à partir de la constante d'acidité et de la concentration. La valeur du pH est un facteur essentiel en chimie, en médecine et dans la vie quotidienne. Lisez le texte ci-dessous pour découvrir ce que sont l'échelle de pH et la formule du pH. À la fin, nous expliquerons également comment calculer le pH étape par étape.
Notre calculateur peut vous demander la concentration de la solution. Si vous ne la connaissez pas, vous pouvez la calculer à l'aide de notre calculateur de concentration. De plus, vous pouvez utiliser le calculateur de dilution de solution 🇺🇸 pour calculer la concentration d'ions dans une solution diluée.
L'échelle de pH
L'échelle de pH est une échelle numérique utilisée pour définir à quel point une solution aqueuse est acide ou basique. Elle se situe généralement entre 0 et 14, mais peut dépasser ces valeurs si la solution est suffisamment acide ou basique. La valeur du pH est logarithmique et est inversement corrélée à la concentration en ions hydrogène dans une solution. La formule pH en H+ qui représente cette relation est la suivante :
La solution est acide si son pH est inférieur à 7. Si le pH est plus élevé, la solution est basique (également appelée alcaline). Les solutions ayant un pH égal à 7 sont neutres.
Outre la méthode mathématique pour déterminer le pH, vous pouvez utiliser des indicateurs de pH. Le test de pH le plus couramment utilisé est le papier tournesol. Il change de couleur en fonction du pH de la solution dans laquelle il est plongé. Ces couleurs inspirent souvent des échelles de pH colorées :
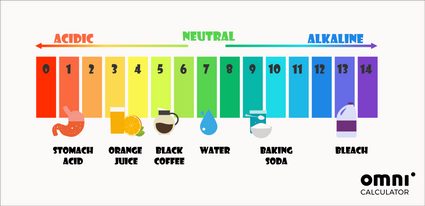
Le pH dans notre corps est proche de la neutralité. Par exemple, le pH du sang devrait se situer autour de 7,4. La seule exception est l'estomac, où les acides gastriques peuvent même atteindre un pH de 1.
Les molécules peuvent avoir un pH pour lequel elles sont dépourvues de charge négative. C'est ce que détermine notre calculateur de point isoélectrique 🇺🇸.
Définitions d'un acide et d'une base
Trois théories différentes définissent l’acide et la base.
- Selon la théorie d'Arrhenius, dans une solution aqueuse, un acide est une substance capable de donner des ions hydrogène, tandis qu'une base donne des ions hydroxyde.
- La théorie de Brønsted-Lowry affirme qu'un acide peut donner des protons tandis qu'une base peut les accepter.
- La théorie de Lewis stipule qu'un acide est quelque chose qui peut accepter des paires d'électrons. De manière analogue, une base donne des paires d'électrons.
Plus la concentration en ions hydrogène provenant de molécules acides est élevée, plus le pH de la solution est faible, et par conséquent, plus elle est acide. Le contraire est vrai pour les ions hydroxyde et les bases. Plus la concentration en ions hydroxyde des molécules basiques est élevée, plus le pH de la solution est élevé, et ainsi, plus elle est basique.
Nous pouvons décrire la réaction d'un acide, HA, dans l'eau comme suit :
avec la constante d'acidité :
Une réaction chimique similaire entre la base BOH et l'eau ressemble à ceci :
L'équation suivante donne la constante de basicité pour la formule ci-dessus :
Si vous souhaitez en savoir plus sur les constantes d'équilibre chimique, consultez le calculateur de constante d'équilibre ou le calculateur de quotient de réaction 🇺🇸.
Comment trouver le pH – Formule du pH
Le pH est défini comme la valeur négative du logarithme décimal de la concentration molaire des ions hydrogène présents dans la solution. L'unité de mesure de la concentration en ions hydrogène est la mole par litre. Pour déterminer le pH, vous pouvez utiliser cette formule du pH :
Si vous connaissez déjà le pH, mais que vous souhaitez calculer la concentration en ions, utilisez cette équation transformée du pH :
Il existe également une échelle de pOH, moins populaire que l'échelle de pH. Le pOH est la valeur négative du logarithme de la concentration en ions hydroxyde :
ou :
Le pH et le pOH sont liés l'un à l'autre par cette équation du pOH et du pH :
Comment calculer le pH ? – Solution étape par étape
Voici les étapes pour calculer le pH d'une solution :
- Supposons que la concentration en ions hydrogène soit égale à 0,000 1 mol/L.
- Calculez le pH en utilisant la formule du pH en H⁺ :
- Maintenant, vous pouvez aussi facilement déterminer le pOH et la concentration en ions hydroxyde en utilisant les formules suivantes :
Bien sûr, vous n'avez pas à effectuer tous ces calculs à la main ! Choisissez l'option permettant de déterminer le pH à l’aide de la concentration en ions dans le calculateur, et saisissez l'une de ces quatre valeurs ! Ensuite, regardez notre outil faire tout le travail à votre place !
- Vous pouvez également trouver un produit chimique dans les listes (d'acides ou de bases). Disons que vous voulez savoir comment trouver le pH de l'acide formique –
HCOOH. SonKaest0,000 18. - Choisissez la concentration du produit chimique. Supposons qu'elle soit égale à
0,1 mol/L. - Pour trouver la concentration des ions H⁺, vous devez... :
où :
Ici, est la concentration molaire de la solution, et est égal à la concentration molaire de H⁺.
Pour 0,1M HCOOH:
Maintenant, vous savez comment calculer le pH à l'aide des équations du pH. Si vous trouvez ces calculs fastidieux, n'hésitez pas à utiliser notre calculateur de pH. Sélectionnez votre produit chimique et sa concentration, et laissez le calculateur faire tout le travail pour vous.
Derrière la création du calculateur de pH
Les biochimistes, les spécialistes de l'environnement et les spécialistes des matériaux ont souvent besoin de calculer ou d'ajuster les valeurs de pH pour leurs recherches. Conscient de ce besoin, j'ai pensé qu'un calculateur de pH accélérerait ces processus, permettant ainsi une expérimentation efficace.
Je suis Julia Żuławińska, le cerveau derrière ce calculateur de pH efficace, et je me distingue comme une figure exemplaire dans la communauté scientifique, en particulier au sein de la biophysique et de la biotechnologie moléculaire. Mes travaux se situent à l'intersection de la science et de la durabilité, soulignant ainsi mon rôle de chercheur avant-gardiste prêt à contribuer à la conservation de l'environnement et à l'innovation biotechnologique.
Il est possible de déterminer les sources de pollution et la santé des écosystèmes en surveillant le pH des masses d'eau naturelles. Les scientifiques de l'environnement pourraient utiliser des calculateurs de pH pour évaluer instantanément la qualité de l'eau.
Nous veillons à ce que nos outils reposent sur des informations authentiques et des recherches appropriées. Après qu'un expert a créé le calculateur, un autre expert du domaine le révise minutieusement. Ensuite, un locuteur natif relit le contenu, ce qui permet de l'affiner encore davantage ; ce n'est qu'ensuite que l'outil est mis à la disposition de nos utilisateurs. Pour en savoir plus sur notre engagement en matière de qualité, veuillez consulter notre politique éditoriale 🇺🇸.
FAQ
Qu'est-ce que le pH ?
Le pH mesure la concentration d'ions hydrogène positifs dans une solution. Cette quantité est corrélée à l'acidité d'une solution : plus la concentration d’ions hydrogène est élevée, plus le pH est bas. Cette corrélation découle de la tendance d'une substance acide à provoquer la dissociation de l'eau : plus la dissociation est importante, plus l'acidité est élevée.
Comment calculer le pH d'une solution ?
Pour calculer le pH d'une solution :
- Mesurez la concentration d’ions hydrogène dans la solution. Vous pouvez également mesurer l'activité de la même espèce. Nous pouvons l'appeler
[H+]. - Calculez le logarithme décimal de cette quantité :
log10([H+]). - Prenez l'inverse additif de cette quantité. Le pH est donné par :
pH = -log10([H+]).
Quelle est la différence entre le pH et le pOH ?
Le pOH est une mesure similaire au pH et correspond à la concentration d’ions hydroxyde d’une solution. La formule du pOH est la suivante :
pOH = -log10([OH-])
Dans des conditions spécifiques (solutions aqueuses à température ambiante), nous pouvons définir une relation utile entre le pH et le pOH :
pH = 14 - pOH
Quels sont des exemples de pH ?
Voici quelques exemples de pH :
- Le pH de l'eau pure est de
7, ce qui est le point médian de l'échelle du pH. - Le pH de notre estomac varie de
1,5à3,5: notre estomac est très acide ! - L'acide de la batterie de votre voiture a un pH d'environ
0,5: ne mettez pas vos mains là-dedans ! - Les produits ménagers comme les déboucheurs de canalisations sont des solutions fortement basiques : certains peuvent atteindre un pH de
14!
Comment utiliser le calculateur de pH ?
Un calculateur de pH est un outil pédagogique inestimable, qui aide aussi bien les élèves que les enseignants. Alors, plongeons dans le vif du sujet et voyons comment ce calculateur de pH peut vous simplifier la vie en quelques étapes simples.
La première chose que vous devez décider est comment calculer le pH. Nous allons vous présenter les étapes de chaque option.
À partir de la concentration d'un acide :
Vous disposez d'une liste d'acides courants. Veuillez choisir l'un d'entre eux.
Ensuite, entrez la concentration en unités molaires.
L'outil déterminera immédiatement le pH et la concentration en ions hydrogène.
Si vous ne trouvez pas votre acide dans la liste des options, choisissez Acide personnalisé.
L'outil calculera les valeurs pH et H+ sur la base des informations fournies.
À partir de la concentration d'une base :
Le calcul du pH d'une base est identique à celui de l'acide mentionné ci-dessus.
La seule différence est que lorsque vous ne trouvez pas la base de votre choix dans la liste des options et que vous choisissez d'entrer une Base personnalisée, vous entrerez la constante d'ionisation (Kb) d'une base au lieu de Ka.
L'outil déterminera instantanément les valeurs pH et H+.
À partir de la masse et du volume d'un acide :
Choisissez l'acide de votre choix dans la liste des 22 acides courants.
Entrez la masse du constituant solide. L'unité par défaut est le gramme, mais vous pouvez sélectionner une autre unité de masse dans la liste selon vos besoins. (Assurez-vous de changer d'unité avant d'entrer la valeur ; sinon, votre entrée ne sera modifiée qu'en fonction de l'unité sélectionnée ultérieurement).
Enfin, indiquez le volume total de la solution.
Le résultat est affiché sous forme de pH et H+.
Vous avez également la possibilité de choisir Acide personnalisé si votre acide ne figure pas dans la liste.
Les pH et H+ sont calculés sur la base des informations fournies.
À partir de la masse et du volume d'une base :
À partir de la concentration en ions :
Le pH peut être calculé à partir de la concentration d'ions en utilisant l'une des trois variables.
a. Concentration des ions hydrogène [H+]
b. Valeur du pH
c. Concentration des ions hydroxyde [OH-].
Vous pouvez saisir n'importe lequel d'entre eux, et les autres seront calculés, ainsi que le résultat : la valeur du pH.
Pour les quatre premières méthodes, cliquez sur la section
Chiffres associéspour afficher la valeur pOH, la concentration d'ions hydroxyde [OH-] et le pKa.