Kalkulator molarności
Nasz kalkulator molarności jest narzędziem do przeliczania stężenia masowego dowolnego roztworu na stężenie molowe (lub przeliczania gramów/ml na mole). Przy jego użyciu możesz również obliczyć masę substancji potrzebną do osiągnięcia pożądanej molarności. Ten artykuł zawiera definicję molarności i wzór na molarność.
Aby zrozumieć temat jako całość, będziesz chciał/a poznać definicję mola, dowiedzieć się o jednostkach molowości, a także przeczytać porównanie dwóch mylących pojęć: wzoru na molowość vs wzór na molalność. Co więcej, przygotowaliśmy dla ciebie kilka interesujących przykładów roztworów molowych oraz krótki samouczek, jak obliczyć krok po kroku molowość stężonego roztworu.
Na koniec możesz poznać definicję miareczkowania i dowiedzieć się, jak znaleźć stężenie molowe za pomocą procesu miareczkowania!
Jak korzystać z kalkulatora molarności
Kalkulator molarności jest prosty i wygodny, o czym zaraz się przekonasz. Ale czy wiesz, jak ważne jest obliczanie molarności? Utrzymanie jakości produktu i zgodności z przepisami bezpieczeństwa wymaga określenia molarności określonych związków chemicznych lub dodatków w przemyśle spożywczym i napojów.
-
Jeśli znasz stężenie roztworu, wprowadź je do czwartej zmiennej kalkulatora. Ciekawostką jest fakt, że stężenie masowe jest równe gęstości czystej substancji. Domyślną jednostką jest tutaj g/mL, gram na mililitr, ale możesz ją zmienić z podanych opcji; upewnij się, że zmieniasz jednostkę przed wprowadzeniem wartości.
-
Następnie wprowadź masę cząsteczkową (lub masę molową) substancji. Domyślną jednostką jest gram na mol, ale możesz ją najpierw zmienić na inne powszechnie używane jednostki.
-
Teraz zobacz, jak dzieje się magia, gdy kalkulator natychmiast określa molarność. Domyślną jednostką jest tutaj molarność (M). Możesz ją zmienić zgodnie z wymaganiami z podanej listy opcji.
-
Ale co zrobisz, jeśli nie masz stężenia masowego substancji? Jak teraz obliczyć molarność? Nasze narzędzie ma odpowiedź również na to pytanie. W takiej sytuacji pozostaw pole stężenia masowego puste.
-
Wprowadź masę substancji w gramach lub w razie potrzeby zmień jednostkę.
-
Na koniec wprowadź objętość roztworu.
-
Nasze narzędzie jest wystarczająco inteligentne, aby określić stężenie masowe i molowość na podstawie podanych przez Ciebie informacji.
Rozważmy przykład. Twoja pożądana substancja to kwas siarkowy, a masa molowa wynosi 98 g/mol przy stężeniu masowym 10 g/ml. Wprowadzając te wartości do kalkulatora, otrzymasz molarność 102,0408 M.
Teraz wyobraź sobie, że nie znasz stężenia masowego kwasu. Zamiast tego masz masę i objętość roztworu jako 970 g H2SO4 w 2,1 L roztworu. Kalkulator molarności powie ci, że molarność twojego kwasu wynosi 4,71331 M, a stężenie masowe to 0,461905 g/ml.
Stężenie molowe — wprowadzenie
Kiedy rozejrzysz się wokół, nawet jeśli siedzisz w domu, zauważysz wiele różnych przedmiotów. Większość z tych materiałów nie jest czysta (jednoskładnikowa). W rzeczywistości są to mieszaniny.
Mieszaniny składają się ze zbioru różnych związków. Czasami liczba pierwiastków może być dość duża, a czasami niewielka, ale tak długo, jak w obiekcie znajduje się więcej niż jeden pierwiastek, jest on mieszaniną. Sok pomarańczowy w szklance, filiżanka herbaty, detergenty w łazience lub mleko — wszystkie te substancje są mieszaninami.
Mieszaniny nie ograniczają się jednak tylko do cieczy, ponieważ zarówno ciała stałe, jak i gazy mogą być mieszaninami; nawet organizmy biologiczne są bardzo złożonymi mieszaninami cząsteczek, gazów i jonów rozpuszczonych w wodzie.
W chemii istnieją dwa rodzaje mieszanin:
-
Mieszaniny jednorodne — składniki są równomiernie rozmieszczone w całej mieszaninie i obserwuje się tylko jedną fazę materii. Są one również znane jako roztwory i mogą występować w stanie stałym, ciekłym lub gazowym. Nie jest możliwe proste rozdzielenie składników mieszaniny w taki sposób, aby żaden ze składników nie uległ zmianie chemicznej. Przykłady mieszanin jednorodnych: woda z cukrem, detergent do mycia naczyń, stal, płyn do spryskiwaczy, powietrze.
-
Mieszaniny niejednorodne — składniki mieszaniny nie są jednolicie rozmieszczone i mogą mieć obszary o różnych właściwościach. Różne próbki mieszaniny nie są identyczne. Co najmniej dwie fazy są zawsze obecne w mieszaninie i zazwyczaj możliwe jest ich fizyczne oddzielenie. Kilka przykładów takich substancji: krew, beton, kostki lodu w coli, pizza, Ocean Spokojny.
Stężenie jest jednym z najbardziej znanych i najważniejszych parametrów dla każdego, kto pracuje z jakimikolwiek substancjami chemicznymi lub reakcjami. Mierzy ono ilość substancji rozpuszczonej w danej objętości roztworu.
Chemicy używają wielu różnych jednostek do opisywania stężenia. Jednak termin molarność, znany również jako stężenie molowe, jest najbardziej powszechnym sposobem wyrażania stężenia. Gdy reagenty (związki) są wyrażane w jednostkach molowych, pozwala to na zapisywanie ich w liczbach całkowitych w reakcjach chemicznych. Ułatwia to pracę z ich ilościami. Najpierw przyjrzyjmy się bliżej, czym jest mol, abyśmy mogli później przejść do ustalenia, czym jest molarność.
Definicja mola
Mol jest jednostką miary w układzie SI określającą ilość substancji. Obecna definicja została przyjęta w 1971 roku i opiera się na węglu-12. Mówi ona:
„Mol to ilość substancji w układzie, która zawiera tyle jednostek elementarnych, ile atomów znajduje się w 0,012 kilograma węgla-12; jej symbolem jest „mol”. Kiedy używamy moli, musimy określić liczbę jednostek elementarnych, które mogą być atomami, cząsteczkami, jonami, elektronami, innymi cząstkami lub określonymi grupami takich cząstek”.
Wynika z tego, że masa molowa węgla-12 wynosi dokładnie 12 gramów na mol, M(¹²C) = 12 g/mol. Słowo "substancja" w definicji powinno określać (zostać zastąpione nazwą) daną substancję w konkretnym zastosowaniu, np. ilość chlorku wodoru (HCl) lub ilość dwutlenku węgla (CO₂). Kluczowe jest, aby zawsze podawać dokładną specyfikację danej jednostki (jak zauważono w drugiej części definicji mola). W tym celu należy podać empiryczny wzór chemiczny danego związku.
Zgodnie z najnowszymi konwencjami (obowiązującymi od 20.05.2019 r.) definicja mola mówi, że mol to ilość substancji chemicznej, która zawiera dokładnie 6,02214076 ⋅ 1023 cząsteczek, takich jak atomy, cząsteczki, jony itp. Liczba ta jest znana jako stała Avogadra. Jej symbolem jest NA lub L. Korzystanie z liczby Avogadra 🇺🇸 zapewnia wygodny sposób rozważania masy substancji i teoretycznej wydajności reakcji chemicznych. Mole pozwalają bezpośrednio odczytać masę z układu okresowego (np. 1 mol N₂ to 28 g lub 1 mol NaCl to 58,5 g).
Możemy powiązać liczbę jednostek X w określonej próbce — N(X), z molami X w tej samej próbce — n(X), następującą relacją: n(X) = N(X)/NA. N(X) jest bezwymiarowe, a n(X) ma jednostkę mol w układzie SI.
Czym jest molarność?
Aby nie mylić podobnych terminów chemicznych, pamiętaj, że molarność oznacza dokładnie to samo, co stężenie molowe (M). Stężenie molowe wyraża stężenie roztworu. Jest ono definiowane jako liczba moli substancji rozpuszczonej na litr roztworu (nie na litr rozpuszczalnika!).
Stężenie = Liczba moli / Objętość
Wzór na molarność
Poniższe równanie pozwala znaleźć molarność roztworu:
molarność = stężenie / masa molowa
Stężenie oznacza stężenie masowe roztworu, wyrażone w jednostkach gęstości (zwykle g/l lub g/ml).
Masa molowa to masa 1 mola substancji rozpuszczonej. Wyrażana jest w gramach na mol. Jest to stała właściwość każdej substancji — na przykład masa molowa wody jest w przybliżeniu równa 18 g/mol.
Nasz kalkulator może również znaleźć masę substancji, którą należy dodać do roztworu, aby uzyskać pożądane stężenie molowe, zgodnie ze wzorem:
masa / objętość = stężenie = molarność ⋅ masa molowa
Gdzie masa to masa substancji rozpuszczonej w gramach, a objętość to całkowita objętość roztworu w litrach.
🔎 Molarność ma wiele zastosowań. Jednym z nich jest obliczanie rozcieńczenia roztworu. Więcej informacji można znaleźć w kalkulator rozcieńczania roztworu 🇺🇸.
Jednostki molarności
Jednostkami stężenia molowego są mole na decymetr sześcienny. Są one zapisywane jako mol/dm³, a także M (wymawiane jako „molowy”). Stężenie molowe substancji rozpuszczonej jest czasami skracane poprzez umieszczenie nawiasów kwadratowych wokół wzoru chemicznego substancji rozpuszczonej, np. stężenie anionów wodorotlenkowych można zapisać jako [OH⁻]. W wielu starszych książkach lub artykułach możesz znaleźć inne jednostki roztworów molowych — mole na litr (mol/l). Należy pamiętać, że jeden decymetr sześcienny równa się jednemu litrowi, więc te dwie notacje wyrażają takie same wartości liczbowe.
Dawniej chemicy podawali stężenia jako masa roztworu/objętość. Obecnie, ponieważ mol stał się najbardziej powszechnym sposobem podawania ilości substancji chemicznej, zamiast tego powszechnie stosuje się molarność.
Należy pamiętać, że molarność może być często mylona z terminem molalność. Molalność jest zwykle zapisywana małymi literami m, podczas gdy molarność (jak wspomniano powyżej) wielkimi literami M. Wyjaśnimy różnicę między tymi dwoma terminami w poniższym akapicie.
Jak obliczyć molarność
- Wybierz substancję. Załóżmy, że jest to kwas solny (HCl).
- Znajdź masę molową swojej substancji. Dla kwasu solnego wynosi ona 36,46 g/mol.
- Określ stężenie masowe substancji — możesz wprowadzić je bezpośrednio lub wypełnić pola dotyczące masy substancji i objętości roztworu. Załóżmy, że masz 5 g HCl w roztworze o objętości 1,2 litra.
- Przekształć powyższe wyrażenia, aby uzyskać wzór na molarność. Ponieważ
masa / objętość = molarność ⋅ masa molowa, tomasa / (objętość ⋅ masa molowa) = molarność. - Podstaw znane wartości, aby obliczyć molarność:
molarność = 5 / (1,2 ⋅ 36,46) = 0,114 mol/l = 0,114 M. - Możesz także użyć naszego kalkulatora molarności, aby znaleźć stężenie masowe lub masę molową. Wystarczy wpisać pozostałe wartości i obserwować, jak kalkulator wykonuje całą pracę za ciebie.
Molarność a molalność
Rozważmy różnice między tymi dwoma podobnie nazwanymi pojęciami chemicznymi: molarność i molalność. Mamy nadzieję, że po przeczytaniu tego akapitu nie będziesz mieć żadnych wątpliwości dotyczących tego tematu.
Oba terminy są używane do wyrażenia stężenia roztworu, ale istnieje między nimi znacząca różnica. Podczas gdy molarność opisuje ilość substancji na jednostkę objętości roztworu, molalność definiuje stężenie jako ilość substancji na jednostkę masy rozpuszczalnika. Innymi słowy, molalność to liczba moli substancji rozpuszczonej na kilogram masy rozpuszczalnika (w którym została rozpuszczona substancja).
Możliwe jest przeliczenie molarności na molowość i odwrotnie. Aby dokonać takiej zmiany, należy skorzystać z poniższego wzoru:
molarność = (molalność ⋅ gęstość masowa roztworu) / (1 + (molalność ⋅ masa molarna roztworu)).
W tabeli molarność a molalność można znaleźć wszystkie główne różnice między tymi dwoma terminami:
Molarność | Molalność | |
|---|---|---|
Definicja | Ilość substancji (w molach) podzielona przez objętość (w litrach) roztworu. | Ilość substancji (w molach) podzielona przez masę (w kg) rozpuszczalnika. |
Symbol | M | m lub b |
Jednostka | mol/L | mol/kg |
Zależność od temperatury i ciśnienia | Zależna | Niezależna |
Zastosowanie | Bardziej popularna, praktyczna do użycia w laboratorium, szybsza i łatwiejsza. | Dokładna, ale rzadko używana. |
Jeśli chcesz dokładniej zgłębić ten temat, zachęcamy do zapoznania się z naszym artykułem .
Roztwór molowy — przykłady z życia wzięte
Jak już wiesz, zawsze otaczają nas mieszaniny i roztwory, które są stałą częścią naszego środowiska. W poniższej tabeli znajduje się lista rzędów wielkości stężeń molowych wraz z przykładami zaczerpniętymi ze środowiska naturalnego.
Molarność | Prefiks SI | Wartość | Element |
|---|---|---|---|
10⁻¹⁵ | fM | 2 fM | Bakterie w powierzchniowych wodach morskich (1×10⁹/L) |
10⁻¹⁴ | – | 50–100 fM | Złoto w wodzie morskiej |
10⁻¹² | pM | 7.51–9.80 pM | Normalny zakres erytrocytów we krwi dorosłego mężczyzny |
10⁻⁷ | – | 101 nM | Jony hydroniowe i wodorotlenkowe w czystej wodzie w 25 °C |
10⁻⁴ | – | 180–480 µM | Normalny zakres kwasu moczowego we krwi |
10⁻³ | mM | 7.8 mM | Górna granica prawidłowego stężenia glukozy we krwi 2 godziny po jedzeniu |
10⁻² | cM | 44.6 mM | Czysty gaz doskonały w 0 °C i przy 101,325 kPa |
10⁻¹ | dM | 140 mM | Jony sodu w osoczu krwi |
10² | hM | 118.8 M | Czysty osm przy 20 °C (22,587 g/cm³) |
10⁴ | hM | 24 kM | Hel w jądrze Słońca (150 g/cm³ ⋅ 65%) |
Określanie stężenia molowego przez miareczkowanie
Miareczkowanie to technika, za pomocą której można określić stężenie nieznanego roztworu na podstawie jego reakcji chemicznej z roztworem o znanym stężeniu. Proces ten polega na dodawaniu titranta (o znanym stężeniu i objętości) do znanej ilości nieznanego roztworu (analitu) aż do zakończenia reakcji. Następnie można określić stężenie analitu, mierząc objętość użytego titranta.
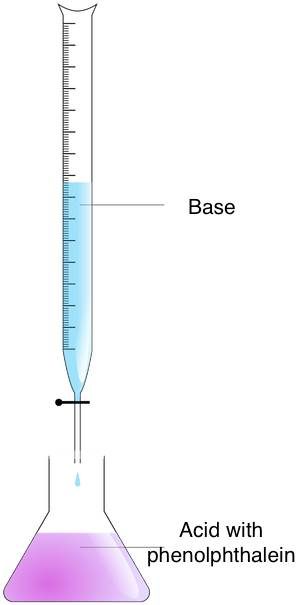
Wykonaj poniższe kroki, aby określić molarność nieznanego roztworu metodą miareczkowania:
- Przygotuj roztwory — umieść analit w kolbie Erlenmeyera, a titrant w biurecie.
- Mieszaj roztwory — dodawaj titrant do analitu aż do osiągnięcia punktu końcowego. Moment ten można określić, obserwując zmianę koloru. W tym celu należy użyć wskaźnika kwasowo-zasadowego. Jeśli użyłeś fenoloftaleiny, zauważysz zmianę koloru z różowego na bezbarwny.
- Oblicz molarność — użyj wzoru na miareczkowanie. Jeśli stosunek titranta do analitu wynosi 1:1, użyj równania:
molarność kwasu ⋅ objętość kwasu = molarność zasady ⋅ objętość zasady.
W przypadku stosunku innego niż 1:1 należy zmodyfikować wzór.
🙋 Dowiedz się więcej, jak obliczyć wyniki miareczkowania w kalkulatorze miareczkowania 🇺🇸.
Przykład: 35 ml 1,25 M kwasu HCl jest potrzebne do zmiareczkowania 25 ml roztworu NaOH. W takim przypadku można użyć wzoru 1:1, ponieważ jeden mol HCl reaguje z jednym molem NaOH. Następnie należy pomnożyć molowość kwasu przez objętość kwasu - 1,25 ⋅ 35 = 43,75, a wynik przez objętość zasady. Molarność zasady wynosi 43,75 / 25 = 1,75 M.
🔎 Sprawdź nasz kalkulator mieszanin 🇺🇸, jeśli chcesz dowiedzieć się, jak uzyskać różne stężenia roztworu.
Powstanie kalkulatora molarności
Możesz zrozumieć, jak wielkie znaczenie ma kalkulator molarności, ponieważ dwa wielkie mózgi w Omni Calculator współpracowały, aby stworzyć go dla ciebie!
Zawodowe i osobiste doświadczenia Bogny Szyk są świadectwem jej wieloaspektowych talentów i poświęcenia. Jej zamiłowanie do tworzenia praktycznych narzędzi, od kalkulatorów po bazy danych Notion, pokazuje jej biegłość techniczną i chęć dzielenia się wiedzą i narzędziami dla dobra innych.
Filip Derma jest szanowaną postacią w dziedzinie inżynierii biomedycznej i elektrycznej. Jego gotowość do podejmowania różnych tematów dodatkowo podkreśla jego wszechstronność i chęć angażowania się w różnorodne wyzwania, pokazując godną pochwały ciekawość intelektualną i zdolność adaptacji.
Filip i Bogna współpracowali nad stworzeniem tego narzędzia, zdając sobie sprawę, że obliczenia molarności mogą być żmudne i że posiadanie kalkulatora molarności będzie przydatną pomocą dydaktyczną, pomagając uczniom szybciej zrozumieć koncepcje i zastosować je w praktycznych scenariuszach bez dezorientacji arytmetycznej.
Zapewniamy, że dzięki naszym narzędziom uzyskasz prawidłową odpowiedź i wkładamy wiele badań i wysiłku w zapewnienie naszym użytkownikom autentycznych informacji, które mogą zastosować w scenariuszach edukacyjnych i praktycznych. Aby dowiedzieć się więcej o naszym zaangażowaniu w jakość, zapoznaj się z naszą stroną .
FAQs
Jak obliczyć pH na podstawie molarności?
- Oblicz stężenie składnika kwasowego/zasadowego roztworu.
- Oblicz stężenie H+ lub OH- w roztworze, jeśli roztwór jest odpowiednio kwasowy lub zasadowy.
- Oblicz -log[H+] dla roztworów o odczynie kwasowym. Wynikiem jest pH.
- Dla roztworów o odczynie zasadowym znajdź -log[OH-] i odejmij go od 14.
Jak sporządzić roztwór molowy?
- Znajdź masę cząsteczkową substancji, z której chcesz sporządzić roztwór molowy w g/mol.
- Pomnóż masę cząsteczkową substancji przez liczbę moli, którą chcesz otrzymać, czyli w tym przypadku 1.
- Odważ obliczoną w kroku 2 liczbę gramów substancji i umieść ją w pojemniku.
- Odmierz 1 litr wybranego rozpuszczalnika i dodaj go do tego samego pojemnika. Otrzymasz teraz roztwór molowy.
Co to jest objętość molowa?
Objętość molowa to objętość, jaką zajmuje jeden mol substancji w określonej temperaturze i pod określonym ciśnieniem. Jest ona obliczana poprzez podzielenie masy molowej przez gęstość substancji przy danej temperaturze i ciśnieniu.
Jak znaleźć liczbę moli na podstawie molarności?
- Znajdź molarność i objętość roztworu.
- Upewnij się, że jednostki objętości są takie same jak dla części molarności związanej z objętością (np. mL i mol/mL).
- Pomnóż objętość przez molarność. Jest to liczba obecnych moli.
Czy molarność jest tym samym co stężenie?
Molarność to nie to samo co stężenie, choć są one do siebie bardzo podobne. Stężenie jest miarą ilości moli substancji rozpuszczonej w danej ilości cieczy i może mieć dowolne jednostki objętości. Molarność to rodzaj stężenia, a konkretnie liczba moli na litr roztworu.
Jaka jest molarność wody?
Woda ma molarność 55,5 M. 1 litr wody waży 1000 g, a ponieważ molarność to liczba moli na litr, znalezienie molarności wody jest tym samym, co znalezienie liczby moli wody w 1000 g. Dlatego dzielimy masę przez masę molową wody, aby uzyskać liczbę moli, 1000 / 18,02 = 55,5 M.
Dlaczego stosujemy molarność?
Molarność jest pomocną miarą używaną podczas omawiania stężenia. Ponieważ stężenie ma duży zakres wielkości jednostek, od nanograma na mililitr do tony na galon, łatwiej jest mieć znaną metrykę do szybkiego porównywania stężeń bez konieczności zajmowania się konwersjami. Jest to molarność (M), czyli mole na litr.