Calculateur de loi de Beer Lambert
Le calculateur de loi de Beer Lambert d'Omni vous permet de calculer l'absorbance d'un matériau ou d'une substance traversés par la lumière. Vous pouvez également utiliser ce calculateur pour déterminer la concentration molaire de votre solution. Poursuivez votre lecture pour découvrir la définition de la loi de Beer Lambert et la formule qui en résulte. Vous apprendrez aussi à calculer la concentration à partir de l'absorbance.
Qu'est-ce que la loi de Beer Lambert ?
La * est parfois appelée loi de Beer-Lambert-Bouguer (en France) ou tout simplement loi de Beer (dans le monde anglo-saxon). Elle met en relation la concentration et l'absorbance d'une solution, qui provoque l'atténuation de la lumière.
La loi de Beer Lambert stipule que lorsqu'un faisceau de rayonnement électromagnétique traverse une solution ou un matériel, l'absorbance de cette solution dépend de sa concentration et de la longueur du trajet parcouru par la lumière.
Si vous souhaitez convertir la concentration molaire d'une substance en pourcentage, consultez notre calculateur de concentration.
*Article disponible uniquement en anglais. Si vous souhaitez approfondir ce sujet en français, cliquez .
Équation de la loi de Beer Lambert
Pour comprendre l'absorbance, examinons la figure 1. Un faisceau lumineux d'une intensité égale à traverse une solution placée dans un récipient de diamètre .
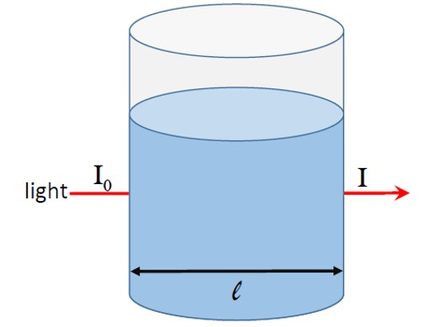
Si la solution absorbe la lumière, alors l'intensité de la lumière sortant du récipient sera inférieure à .
où :
- – l'absorbance de la solution
- – l'intensité de la lumière à la sortie
Nous pouvons exprimer l'équation de la loi de Beer Lambert comme suit :
où :
- – le coefficient d'extinction molaire, aussi appelé absorptivité molaire
- – la longueur du trajet parcouru par la lumière
- – la concentration de la solution
En spectroscopie, la longueur du trajet est généralement exprimée en , alors que l'absorbance n'a pas d'unité. On exprime la concentration de la solution en , et donc le coefficient d'extinction molaire est exprimé en .
Nous vous conseillons de jeter un coup d'œil au calculateur de concentration molaire, qui permet de convertir la concentration massique d'une solution en concentration molaire.
Conversion de l'absorbance en transmittance
Dans la figure 1, nous pouvons voir la fraction de lumière qui sort de l'autre côté du récipient. Cette fraction de lumière s'appelle transmittance, . Elle est exprimée en pourcentage et elle est donnée par l'équation suivante :
Par conséquent, nous pouvons établir la relation entre l'absorbance et la transmittance de la manière suivante :
Comme vous pouvez le voir, la relation entre l'absorbance et la transmittance est logarithmique. Donc, une absorbance de implique une transmittance de .
Dans la spectrophotométrie, on mesure l'intensité du rayonnement qui entre dans la solution, et ensuite, l'intensité de celui qui sort. Nous utilisons ensuite ces deux valeurs pour calculer la transmittance ou l'absorbance.
Applications de la loi de Beer Lambert
La plupart des techniques d'analyse spectroscopique en chimie sont basées sur la loi de Beer Lambert. En chimie analytique, elle est souvent utilisée pour :
- déterminer la concentration des solutions en mesurant l'absorbance ; ou
- établir l'identité d'une substance inconnue en déterminant son absorptivité molaire.
Consultez notre calculateur d'alligation 🇺🇸 pour calculer les proportions de deux substances afin d'obtenir une concentration donnée.
FAQ
Quelle est l'unité de l'absorbance dans la loi de Beer Lambert ?
L'absorbance n'a pas d'unité. C'est le rapport entre l'intensité de la lumière qui entre et celle qui sort d'une solution (après l'avoir traversé) ; Donc, les unités s'annulent. Mais parfois, on exprime l'absorbance en unités d'absorption (UA).
Comment calculer la concentration molaire à partir de la loi de Beer Lambert ?
Pour calculer la concentration molaire à partir de la loi de Beer Lambert, procédez comme suit :
- Multipliez la longueur du trajet parcouru par la lumière par la concentration molaire de la solution.
- Divisez l'absorbance par la valeur obtenue à l'étape 1.
- Félicitations ! Vous avez calculé avec succès la concentration molaire à partir de la loi de Beer Lambert.
Comment calculer la concentration à partir de l'absorbance dans la loi de Beer Lambert ?
La loi de Beer Lambert est souvent utilisée pour déterminer la concentration des solutions. Pour calculer la concentration d'une solution à partir de la loi de Beer Lambert, vous devrez suivre quelques étapes :
- Déterminez l'absorbance de la solution lorsqu'une lumière de longueur d'onde donnée la traverse.
- Déterminez la longueur du trajet parcouru par la lumière.
- Multipliez le coefficient d'extinction molaire par la longueur du trajet.
- Divisez l'absorbance par la valeur obtenue à l'étape 3 pour obtenir la concentration de la solution.
Comment calculer la transmittance à partir de l'absorbance ?
Voici les étapes à suivre pour calculer la transmittance à partir de l'absorbance :
- Soustrayez l'absorbance de 2.
- Si vous prenez l'antilogarithme de la valeur obtenue à l'étape 1, vous obtiendrez la transmittance en pourcentage.
- Vous pouvez également utiliser notre calculateur de loi de Beer Lambert pour calculer la transmittance.
Comment utiliser le calculateur de loi de Beer Lambert ?
Voyons maintenant comment utiliser le calculateur de loi de Beer Lambert pour calculer l'absorbance d'une solution de dont la concentration molaire est égale à 4,33×10−5 mol⋅L−1. Soit la longueur du trajet parcouru par la lumière égale à 1 cm, et l'absorptivité molaire (coefficient d'extinction molaire), à 8400 M−1⋅cm−1.