Calculadora de Distribuição Eletrônica
A calculadora de distribuição eletrônica da Omni, também conhecida como calculadora de configuração eletrônica, mostrará instantaneamente a distribuição de elétrons nos orbitais de qualquer elemento periódico que você escolher. Normalmente, são necessários pelo menos 8 passos para determinar a distribuição eletrônica, começando por encontrar o número atômico observando a lista de orbitais e entendendo a notação.
Mas espere, você pode evitar tudo isso se usar a nossa ferramenta! Economize tempo e esforço simplesmente selecionando o nome do elemento e obtendo a distribuição eletrônica completa, juntamente com o número atômico e a massa de todos os 118 elementos conhecidos. Além disso, esta ferramenta também funciona como uma calculadora de elétrons de valência e fornece os elétrons de valência de todos os elementos da tabela periódica.
Você está pronto para se destacar em seu curso de ciências? Continue lendo para descobrir o que é uma distribuição eletrônica, o que são os elétrons de valência e como encontrar os elétrons de valência de qualquer elemento.
Distribuição eletrônica no estado fundamental
A notação da distribuição eletrônica nos fornece informações sobre os níveis e subníveis básicos de energia que os elétrons ocupam. Estado fundamental significa que o átomo tem a menor energia permitida. A distribuição eletrônica é responsável por muitas propriedades físicas e químicas de um elemento. Vejamos a distribuição eletrônica do hélio, que é .
-
O primeiro número inteiro, , indica o primeiro nível de energia. Em geral, seus valores podem estar entre e , em que é o valor da camada mais externa que contém um elétron.
-
A letra indica o tipo de orbital (também conhecido como subcamada). Diferentes subcamadas podem hospedar um número diferente de elétrons: a subcamada tem no máximo elétrons, a subcamada tem até elétrons, a subcamada até elétrons e a subcamada até elétrons.
-
O sobrescrito 2 () informa a você a ocupação de elétrons na subcamada correspondente.
Agora podemos ver que cada elétron tem um “endereço” exclusivo no átomo. Visite nossa calculadora de números quânticos 🇺🇸 para saber mais sobre os valores possíveis para uma determinada camada ou subcamada de elétrons.
Distribuição eletrônica: diagrama de Pauling e a regra de Hund
Para escrever a distribuição eletrônica de um determinado átomo, usamos regras gerais:
- O princípio de Aufbau (do alemão “Aufbau” que significa “construção”) afirma que os elétrons sempre ocupam orbitais de energia crescente, portanto, a ordem na qual os orbitais são ocupados segue a ordem representada na ilustração abaixo, também conhecida como diagrama de Linus Pauling:
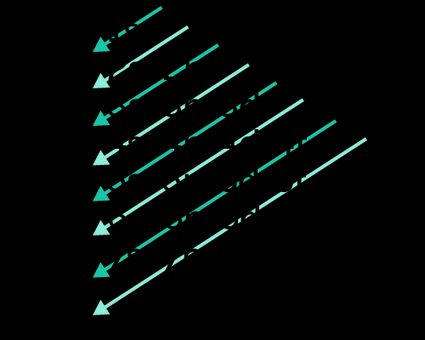
A ordem é a seguinte:
1s ← 2s ← 2p ← 3s ← 3p ← 4s ← 3d ← 4p ← 5s ← 4d ← 5p ← 6s ← 4f ← 5d ← 6p ← 7s ← 5f ← 6d ← 7p
-
A regra de Hund afirma que um átomo no estado fundamental sempre tem o maior número possível de elétrons desemparelhados. Isso significa dizer que os pares de elétrons só se formam após todos os níveis orbitais terem sido preenchidos por elétrons desemparelhados. Por exemplo, a configuração eletrônica do estado fundamental do nitrogênio () indica que ele tem elétrons ocupando o orbital . Baseado na regra de Hund, um elétron preenche cada orbital, e cada elétron tem o mesmo spin. Resumidamente, o spin do elétron determina se o átomo gerará um campo magnético. Seus valores são limitados a (seta para cima) ou (seta para baixo). Se os spins estiverem emparelhados, nenhum campo magnético aparecerá, mas um elétron desemparelhado determinará o spin.
-
O princípio de exclusão de Pauli significa que, se dois elétrons ocuparem os mesmos orbitais, seus spins devem estar emparelhados, conforme indicado pela direção das setas (↑) e (↓).
Vamos combinar essas regras para escrever a configuração eletrônica do carbono com um número atômico de 6 (o que significa que ele contém 6 elétrons em seu estado fundamental).
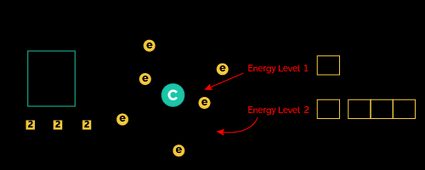
De acordo com o diagrama de Linus Pauling, colocaremos 6 elétrons nos seguintes orbitais:
Os orbitais e são sucessivamente completamente preenchidos com dois elétrons. Agora, os próximos dois elétrons entrarão no orbital no sentido anti-horário, como pode ser visto no diagrama dos orbitais do átomo de carbono.
Como escrever a distribuição eletrônica usando o método abreviado?
Os químicos descobriram um método para escrever a distribuição eletrônica de forma mais simples, usando o método abreviado. Vamos voltar à configuração eletrônica do nitrogênio para reescrevê-la como:
-
Encontre o número atômico do nitrogênio (7) e use esta calculadora de distribuição eletrônica para obter uma distribuição eletrônica completa. Caso contrário, escreva a ordem dos níveis de energia com a ajuda do diagrama de Linus Pauling: .
-
Coloque os colchetes ao redor da configuração eletrônica do último gás nobre, elemento do grupo 18, antes do nitrogênio. Observe que o hélio (He) é o gás nobre que precede o nitrogênio.
-
Continue com a distribuição eletrônica após o hélio. Portanto, para o nitrogênio, teríamos:
Da mesma forma, podemos usar o método abreviado para escrever a distribuição eletrônica do carbono, tendo em mente que ele terá 1 elétron a menos na camada do que o nitrogênio, portanto, . Esse método funciona bem para escrever a distribuição eletrônica de qualquer elemento.
O que são elétrons de valência?
Os elétrons de valência (ou seja, os elétrons na subcamada mais externa) têm a maior energia. Eles são particularmente importantes porque estão envolvidos na formação de ligações e determinam as propriedades químicas de um elemento. Saiba mais sobre como a atração de um elétron por um núcleo mudará com nossa calculadora de carga nuclear efetiva 🇺🇸.
Como encontrar os elétrons de valência de um elemento escolhido? Você pode verificar isso imediatamente em nossa calculadora de elétrons de valência à esquerda ou observar a posição de um átomo específico na tabela periódica, que te ajudará a determinar quantos elétrons de valência um átomo neutro desse elemento tem. O número do grupo em que um elemento se encontra determina o número de seus elétrons de valência.
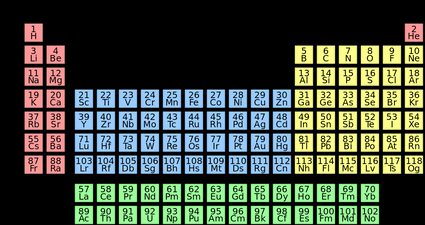
Por exemplo, o cloro está no grupo 7, portanto, tem sete elétrons de valência. De fato, podemos escrever sua distribuição eletrônica como . Como podemos ver, o cloro tem sete elétrons nos orbitais e , que são os elétrons de valência.
Para os grupos 13 a 18, subtraia 10 do número do grupo para obter o número de elétrons de valência, por exemplo, os elementos do grupo 13 terão três elétrons de valência, os do grupo 14 quatro elétrons de valência e assim sucessivamente.
Um caso notável é o grupo 18, no qual os elementos (conhecidos como gases nobres) têm 8 elétrons de valência. Esse é um arranjo tão estável da camada de elétrons que eles essencialmente não têm nenhum elétron de valência disponível para ligação ou reação.
Exemplos de como usar nossa calculadora de distribuição eletrônica
Usemos esta inteligente calculadora de distribuição eletrônica para determinar a configuração eletrônica do cobre:
-
Escolha cobre (Cu) na lista suspensa de elementos.
-
Verifique o número atômico (29) e a massa atômica (63,546) do cobre. Leia aqui como calcular a massa atômica 🇺🇸.
-
Leia a distribuição eletrônica completa: .
Agora você pode dizer: “Espere um minuto! De acordo com o diagrama de Linus Pauling e o princípio de Aufbau, a calculadora de distribuição eletrônica não deveria informar isso como ? Afinal de contas, primeiro preenchemos a camada e depois a .”
Bem, no átomo de cobre, há uma disrupção da ordem de preenchimento das subcamadas de elétrons, ou seja, o salto de um dos elétrons do para o é energeticamente mais favorável. Um fenômeno semelhante ocorre nos átomos de cromo e ouro.
- Agora, use nossa ferramenta como uma calculadora de elétrons de valência e verifique os elétrons de valência do cobre: .
Sabemos, pela tabela periódica, que o cobre está no grupo 11, portanto, isso está de acordo com o resultado desta calculadora de distribuição eletrônica.
O que é distribuição eletrônica?
A distribuição ou configuração eletrônica do estado fundamental de um átomo descreve como os elétrons foram distribuídos entre as camadas e subcamadas orbitais. Conforme o diagrama de Linus Pauling, os elétrons em um átomo ocupam orbitais segundo o aumento de sua energia, com cada orbital tendo no máximo dois elétrons emparelhados com spins opostos.
Como escrever a distribuição eletrônica do oxigênio?
Para encontrar a distribuição eletrônica do oxigênio:
- Observe a tabela periódica e encontre o número atômico do oxigênio, que é 8.
- Preencha esses 8 elétrons na seguinte ordem: 1s, 2s e, em seguida, 2p.
- Escreva a distribuição eletrônica completa do oxigênio: 1s²2s²2p⁴.
- Identifique o gás nobre antes do oxigênio, hélio, e escreva usando a notação abreviada: [He]2s²2p⁴.
Como encontrar a distribuição eletrônica dos íons?
Se um átomo perdeu ou ganhou elétrons ao mudar para um cátion ou ânion, siga estas etapas:
-
Adicione um elétron à configuração eletrônica do ânion. Por exemplo, a configuração eletrônica do estado fundamental do cloro é 1s²2s²2p⁶3s²3p⁵. Para o Cl-, ela será 1s²2s²2p⁶3s²3p⁶.
-
Remova os elétrons mais externos no cátion, por exemplo, a configuração eletrônica para Mg2+ será 1s²2s²2p⁶.
Que elemento tem a distribuição eletrônica 1s2 2s2 2p6 3s2 3p4?
Enxofre (S). Você pode somar o número de elétrons em todas as subcamadas e obterá o número 16. Em seu estado fundamental, ele corresponde a um número atômico que é exclusivo do enxofre na tabela periódica.
Quantos elétrons de valência o carbono tem?
4. O número atômico do carbono é 6, e a distribuição eletrônica completa desse átomo é 1s²2s²2p². Você pode ver que, na tabela periódica, o carbono está no grupo 4, portanto, tem 4 elétrons de valência.
Quantos elétrons de valência tem o oxigênio?
6. O oxigênio está no grupo 16 da tabela periódica, portanto, assim como os outros elementos dos grupos 13-18, você pode subtrair 10 do número do grupo para descobrir o número de elétrons de valência. Portanto, o oxigênio tem 6 deles, dois na subcamada 2s e quatro na subcamada 2p.