Calculadora de Molaridade
- Como usar a calculadora de molaridade
- Concentração molar: uma introdução
- Definição do mol
- O que é molaridade?
- Fórmula da molaridade
- Unidades de molaridade
- Como calcular a molaridade
- Molaridade versus molalidade
- Solução molar: exemplos no dia a dia
- Determinação da concentração molar por titulação
- Invenção da calculadora de molaridade
- FAQ
A calculadora de molaridade da Omni é uma ferramenta para você converter a concentração de massa de qualquer solução em concentração molar (ou recalcular gramas por ml em mols). Você também pode calcular a massa de uma substância necessária para atingir uma molaridade desejada. Este artigo fornecerá a você a definição de molaridade e a fórmula da molaridade.
Para entender este tema em sua totalidade, é necessário aprender sobre a definição de mol, as unidades de molaridade, bem como entender a diferença entre dois conceitos enganosos: a fórmula da molaridade e a fórmula da molalidade. Tudo isso você vai encontrar no texto abaixo. Além disso, preparamos para você alguns exemplos interessantes de soluções molares e um breve tutorial passo a passo de como calcular a molaridade de uma solução concentrada. Se quiser aprender mais sobre molalidade, dê uma olhada na calculadora de molalidade.
No final do texto, você pode aprender a definição de titulação e descobrir como encontrar a concentração molar usando o processo de titulação!
Como usar a calculadora de molaridade
A calculadora de molaridade é simples e conveniente, e você descobrirá isso em breve. Mas você sabia que calcular a molaridade é muito importante? Por exemplo, para manter a qualidade do produto e a conformidade com as normas de segurança, você precisa determinar a molaridade de compostos químicos ou aditivos específicos no setor de alimentos e bebidas.
-
Se você souber a concentração da solução, insira-a na 4ª variável da calculadora. Um fato interessante é que a concentração de massa é igual à sua densidade para uma substância pura. A unidade padrão aqui é g/mL, gramas por mililitro, mas você pode alterá-la nas opções fornecidas; certifique-se de alterar a unidade antes de inserir o valor.
-
Em seguida, insira o peso molecular (ou massa molar) da substância. A unidade padrão é gramas por mol, mas você pode alterá-la primeiro para outras unidades comumente usadas.
-
Agora, você verá a mágica acontecer quando a calculadora determinar instantaneamente a molaridade. A unidade padrão aqui é molares (M). Você pode alterá-la de acordo com suas necessidades na lista de opções fornecida.
-
Mas o que fazer se você não tiver a concentração de massa da substância? Como você calcula a molaridade agora? Nossa ferramenta também tem a resposta para isso. Nessa situação, deixe a concentração de massa vazia.
-
**Insira a massa da substância em gramas ou altere a unidade, se necessário.
-
Por fim, insira o volume da solução.
-
Nossa ferramenta é inteligente o suficiente para determinar a concentração de massa e a molaridade com base nas informações que você forneceu.
Vamos considerar um exemplo. A substância que você deseja é ácido sulfúrico, e a massa molar é 98 g/mol com uma concentração de massa de 10 g/ml. Ao inserir esses valores na calculadora, você obterá a molaridade como 102,0408 M.
Agora, imagine que você não saiba a concentração de massa do ácido. Em vez disso, você tem a massa e o volume da solução como 970 g de H2SO4 em uma solução de 2,1 L. A calculadora de molaridade dirá a você que a molaridade do seu ácido é 4,71331 M, com a concentração de massa sendo 0,461905 g/ml.
Concentração molar: uma introdução
Ao olhar ao redor, mesmo que esteja sentado em casa, você notará muitos objetos diferentes. A maioria desses materiais não são puros. Eles são, de fato, misturas.
As misturas consistem em uma coleção de compostos diferentes. Ocasionalmente, o número de elementos pode ser bem alto ou, às vezes, bem baixo, mas desde que haja mais de um elemento em um objeto, ele é uma mistura. Desde o suco de laranja no seu copo até a xícara de chá, leite ou mesmo os detergentes no banheiro: todas essas substâncias são misturas.
No entanto, as misturas não se limitam apenas a líquidos; sólidos e gases podem ser misturas; até mesmo os organismos biológicos são misturas muito complexas de moléculas, gases e íons dissolvidos na água.
Na química, há dois tipos de misturas:
-
Misturas homogêneas — Os componentes são distribuídos uniformemente por toda a mistura e há apenas uma fase de matéria observada. Elas também são conhecidas como soluções e podem ocorrer no estado sólido, líquido ou gasoso. Apesar de não haver ocorrido nenhuma alteração química em nenhum dos componentes da mistura, não é possível simplesmente separar os componentes que formam parte dela. Exemplos: água com açúcar, detergente para lavar louça, aço, fluido de lavagem de para-brisa, ar.
-
Misturas heterogêneas — Os componentes da mistura não estão distribuídos uniformemente e podem ter regiões com propriedades diferentes. Diferentes amostras da mistura não são idênticas. Pelo menos duas fases estão sempre presentes na mistura, e geralmente é possível separá-las fisicamente. Alguns exemplos de tais substâncias: sangue, concreto, cubos de gelo em refrigerante, pizza, o Oceano Pacífico.
A concentração é um dos parâmetros mais conhecidos e mais importantes para qualquer pessoa que trabalhe com substâncias ou reações químicas. Ela mede a quantidade de uma substância dissolvida em um determinado volume de solução.
Os químicos usam muitas unidades diferentes para descrever a concentração. No entanto, o termo molaridade, também conhecido como concentração molar, é a forma mais comum de expressar a concentração. Quando os reagentes (compostos) são expressos em unidades mol, isso permite que eles sejam escritos com números inteiros em reações químicas. Isso ajuda você a trabalhar facilmente com suas quantidades. Primeiro, vamos dar uma olhada mais de perto no que é o mol, para que possamos seguir adiante e descobrir o que é a molaridade.
Definição do mol
O mol é a unidade de medida do SI para a quantidade da substância. A definição atual foi adotada em 1971 e é baseada no carbono-12. Ela diz o seguinte:
“O mol é a quantidade de substância de um sistema que contém tantas entidades elementares quanto o número de átomos em 0,012 quilograma de carbono-12; seu símbolo é “mol”. Quando o mol é usado, as entidades elementares devem ser especificadas e podem ser átomos, moléculas, íons, elétrons, outras partículas ou grupos especificados de tais partículas.”
Segue-se que a massa molar do carbono-12 é exatamente 12 gramas por mol, M(¹²C) = 12 g/mol. A palavra “substância” na definição deve especificar a substância em questão, dada uma aplicação específica, por exemplo, a quantidade de cloreto (HCl) ou a quantidade de dióxido de carbono (CO₂). É fundamental que você sempre forneça uma especificação precisa da entidade envolvida (conforme observado na segunda parte da definição de mol). Isso deve ser feito fornecendo a fórmula química empírica do composto envolvido.
Conforme as convenções mais recentes (em vigor a partir de 20 de maio de 2019), a definição de mol é que um mol é a quantidade de uma substância química que contém exatamente 6,02214076 ⋅ 1023 partículas, como átomos, moléculas, íons etc. Esse número é conhecido como Constante de Avogadro. Seu símbolo é NA ou L. O uso do número de Avogadro fornece uma maneira conveniente de considerar o peso da substância e o rendimento teórico das reações químicas. Os mols permitem que você leia diretamente o peso da tabela periódica (por exemplo, 1 mol de N₂ é 28 g ou 1 mol de NaCl é 58,5 g). Para saber mais sobre o número de Avogadro e o rendimento teórico, consulte a calculadora do número de Avogadro e a calculadora de rendimento teórico da Omni.
Podemos vincular o número de entidades X em uma amostra específica N(X) aos mols de X na mesma amostra n(X) com a relação: n(X) = N(X)/NA. N(X) não tem dimensão, e n(X) tem a unidade SI mol.
O que é molaridade?
Para que você não se confunda com termos químicos semelhantes, lembre-se de que molaridade significa exatamente o mesmo que concentração molar (M). A molaridade expressa a concentração de uma solução. Ela é definida como o número de mols de uma substância ou soluto dissolvido por litro de solução (não por litro de solvente!).
concentração = número de mols / volume
Fórmula da molaridade
A equação a seguir permite que você encontre a molaridade de uma solução:
molaridade = concentração / massa molar
A concentração indica a concentração de massa da solução, expressa em unidades de densidade (geralmente g/l ou g/ml).
Massa molar é a massa de 1 mol do soluto. Ela é expressa em gramas por mol. É uma propriedade constante de cada substância. Por exemplo, a massa molar da água é aproximadamente igual a 18 g/mol.
Nossa calculadora também pode encontrar a massa da substância que você precisa adicionar à sua solução para obter a concentração molar desejada, de acordo com a fórmula:
massa / volume = concentração = molaridade × massa molar
onde massa é a massa do soluto (substância) em gramas e volume é o volume total da solução em litros.
🔎 A molaridade tem muitas aplicações. Uma delas é o cálculo da diluição da solução. Saiba mais na calculadora da diluição de solução 🇺🇸.
Unidades de molaridade
As unidades de concentração molar são mols por decímetro cúbico. Elas são registradas como mol/dm³ e também como M (pronuncia-se "molar"). A concentração molar do soluto às vezes é abreviada colocando-se colchetes ao redor da fórmula química do soluto; por exemplo, a concentração de ânions de hidróxido pode ser escrita como [OH-]. Em muitos livros ou artigos antigos, você pode encontrar diferentes unidades de soluções molares: mols por litro (mol/l). Lembre-se de que um decímetro cúbico é igual a um litro, portanto, essas duas notações expressam os mesmos valores numéricos.
Antigamente, os químicos costumavam dar concentrações como o "peso do soluto/volume". Atualmente, como a molécula se tornou a forma mais comum de citar a quantidade de uma substância química, a molaridade é comumente usada em seu lugar.
Observe que molaridade pode ser frequentemente confundida com o termo molalidade. A molalidade geralmente é escrita com letra minúscula m, enquanto a molaridade (como mencionado acima) é escrita com letra maiúscula M. Explicaremos a diferença entre esses dois termos em um parágrafo abaixo.
Como calcular a molaridade
- Escolha sua substância. Vamos supor que seja o ácido clorídrico (HCl).
- Encontre a massa molar de sua substância. Para o ácido clorídrico, ela é igual a 36,46 g/mol.
- Decida a concentração de massa da sua substância. Vamos supor que você tenha 5 g de HCl em uma solução de 1,2 litro.
- Converta as expressões acima para obter uma fórmula de molaridade. Como
massa / volume = molaridade × massa molar, entãomassa / (volume × massa molar) = molaridade. - Substitua os valores conhecidos para calcular a molaridade:
molaridade = 5 / (1,2 ⋅ 36,46) = 0,114 mol/l = 0,114 M. - Você também pode usar a calculadora de molaridade da Omni para encontrar a concentração de massa ou a massa molar. Basta digitar os valores restantes e ver a calculadora fazer todo o trabalho para você.
Molaridade versus molalidade
Consideremos as diferenças entre esses dois conceitos químicos com nomes semelhantes: molaridade e molalidade. Esperamos que, após ler este parágrafo, você não tenha mais dúvidas sobre esse tópico.
Ambos os termos são usados para expressar a concentração de uma solução, mas há uma diferença significativa entre eles. Enquanto a molaridade descreve a quantidade de substância por unidade de volume da solução, a molalidade define a concentração como a quantidade de substância por unidade de massa do solvente. Em outras palavras, a molalidade é o número de mols de soluto (material dissolvido) por quilograma de solvente (no qual o soluto está dissolvido).
É possível encontrar a molaridade a partir da molalidade e vice-versa. Para fazer esse cálculo, use a fórmula abaixo:
molaridade = (molalidade × densidade_de_massa_da_solução) / (1 + (molalidade × massa_molar_do_soluto))
Nesta tabela de molaridade versus molalidade, você pode encontrar todas as principais diferenças entre esses dois termos:
Molaridade | Molalidade | ||
|---|---|---|---|
Definição | Quantidade de substância (em mols) dividida pelo volume (em litros) da solução. | Quantidade de substância (em mols) dividida pela massa (em kg) do solvente. | |
Símbolo | M | m ou b | |
Unidade | mol/L | mol/kg | |
Temperatura e pressão | Dependente | Independente | |
Uso | Mais popular, prático para uso em laboratório, pois é mais rápido e fácil. | Preciso e usado com menos frequência. |
Solução molar: exemplos no dia a dia
Como você já sabe, as misturas e soluções estão sempre ao nosso redor e são uma parte permanente do ambiente. Na tabela abaixo, você pode encontrar a lista de ordens de magnitude da concentração molar, com exemplos retirados do ambiente natural.
M | Prefixo SI | Valor | Item |
|---|---|---|---|
10-¹⁵ | fM | 2 fM | Bactérias na água do mar superficial (1 ⋅ 10⁹/L) |
10-¹⁴ | – | 50-100 fM | Ouro na água do mar |
10-¹² | pM | 7,51-9,80 pM | Faixa normal de eritrócitos no sangue de um homem adulto |
10-⁷ | – | 101 nM | Íons hidrônio e hidróxido em água pura a 25 °C |
10-⁴ | – | 180-480 µM | Faixa normal de ácido úrico no sangue |
10-³ | mM | 7,8 mM | Limite superior de glicose saudável no sangue 2 horas após a refeição |
10-² | cM | 44,6 mM | Gás ideal puro a 0 °C e 101,325 kPa |
10-¹ | dM | 140 mM | Íons de sódio no plasma sanguíneo |
10² | hM | 118,8 M | Ósmio puro a 20 °C (22,587 g/cm³) |
10⁴ | hM | 24 kM | Hélio no núcleo solar (150 g/cm³ ⋅ 65%) |
Determinação da concentração molar por titulação
A titulação é uma técnica com a qual você pode encontrar a concentração de uma solução desconhecida, com base em sua reação química com uma solução de concentração conhecida. Nesse processo, você adiciona um reagente chamado titulante, cuja concentração e volume são conhecidos, a uma quantidade conhecida de uma solução desconhecida, chamada analito. Essa adição continua até que a reação entre o titulante e o analito esteja completa. Através da medição do volume do titulante usado, é possível determinar a concentração do analito.
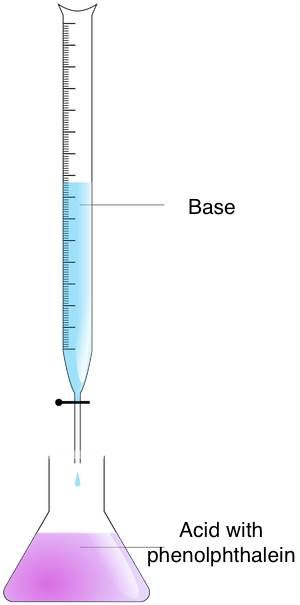
Siga estas etapas para encontrar a molaridade de uma solução desconhecida com o método de titulação:
- Prepare as concentrações — Coloque o analito em um frasco Erlenmeyer e o titulante em uma bureta.
- Misture as concentrações — Adicione o titulante ao analito até que o ponto final seja atingido. Você pode encontrar esse momento observando a mudança de cor. Use o indicador ácido-base para essa finalidade. Se tiver usado fenolftaleína, você perceberá uma mudança de cor de rosa para incolor.
- Calcule a molaridade — Use a fórmula de titulação. Se a proporção entre o titulante e o analito for de 1:1, use a equação:
molaridade_do_ácido × volume_do_ácido = molaridade_da_base × volume_da_base.
Para proporções diferentes de 1:1, você precisa modificar a fórmula.
🙋 Saiba como calcular titulações na calculadora de titulação da Omni.
Exemplo: São necessários 35 ml de ácido HCl 1,25 M para titular uma solução de NaOH de 25 ml. Nesse caso, você pode usar a fórmula 1:1 porque um mol de HCl reage com um mol de NaOH. Em seguida, multiplique a molaridade do ácido pelo volume do ácido: 1,25 ⋅ 35 = 43,75 e o resultado, pelo volume da base. A molaridade da base é igual a 43,75 / 25 = 1,75 M.
🔎 Não deixe de conferir a calculadora de mistura de ingredientes 🇺🇸 da Omni se você estiver interessado em saber como obter diferentes concentrações de uma solução.
Invenção da calculadora de molaridade
Você pode entender a magnitude da importância da calculadora de molaridade porque dois de nossos grandes cérebros colaboraram para criar essa ferramenta conveniente.
**A jornada profissional e pessoal de Bogna Szyk é um testemunho de seus talentos multifacetados e de sua dedicação. Seu amor pelo desenvolvimento de ferramentas práticas, de calculadoras a bancos de dados, demonstra sua proficiência técnica e seu desejo de compartilhar conhecimento e ferramentas para a melhoria dos outros.
Filip Derma é uma figura distinta e confiável em engenharia biomédica e elétrica. Sua disposição para abraçar vários assuntos ressalta ainda mais sua versatilidade e vontade de se envolver com diversos desafiadores, demonstrando uma curiosidade intelectual e adaptabilidade.
Filip e Bogna colaboraram para criar essa ferramenta, pois perceberam que os cálculos de molaridade poderiam ser entediantes e que ter uma calculadora de molaridade seria uma ferramenta útil de ensino, ajudando os alunos a entender os conceitos mais rapidamente e a aplicá-los em cenários práticos sem se confundir com a aritmética.
Asseguramos que nossas ferramentas forneçam a você a resposta correta e dedicamos muita pesquisa e esforço para garantir que informações autênticas sejam fornecidas aos nossos usuários, as quais eles podem aplicar em cenários educacionais e práticos. Para saber mais sobre nosso compromisso com a qualidade, consulte nossa página .
FAQ
Como calcular o pH a partir da molaridade?
- Calcule a concentração do componente ácido/alcalino de sua solução.
- Calcule a concentração de H+ ou OH- em sua solução se ela for ácida ou alcalina, respectivamente.
- Calcule o -log[H+] para soluções ácidas. O resultado é o pH.
- Para soluções alcalinas, encontre o -log[OH-] e subtraia-o de 14.
Como fazer uma solução molar?
- Encontre o peso molecular da substância da qual você gostaria de fazer uma solução molar em g/mol.
- Multiplique o peso molecular da substância pelo número de mols que você deseja obter, que, nesse caso, é 1.
- Pese o número de gramas que você calculou na etapa 2 da sua substância e coloque-o em um recipiente.
- Meça 1 litro do solvente que você escolheu e adicione-o ao mesmo recipiente. Você agora tem uma solução molar.
O que é volume molar?
O volume molar é o volume que um mol de uma substância ocupa em uma determinada temperatura e pressão. Ele é encontrado dividindo-se a massa molar pela densidade da substância nessa temperatura e pressão.
Como encontrar mols a partir da molaridade?
- Encontre a molaridade e o volume de sua solução.
- Certifique-se de que as unidades para o volume sejam as mesmas que para a parte do volume da molaridade (por exemplo, mL e mol/mL).
- Multiplique o volume pela molaridade. Esse é o número de mols presentes na solução.
Molaridade é o mesmo que concentração?
A molaridade não é o mesmo que a concentração, embora sejam muito semelhantes. A concentração é uma medida de quantos mols de uma substância estão dissolvidos em uma quantidade de líquido e pode ter qualquer unidade de volume. A molaridade é um tipo de concentração, especificamente mols por litro de solução.
Qual é a molaridade da água?
A água tem uma molaridade de 55,5 M. 1 litro de água pesa 1.000 g e, como a molaridade é o número de mols por litro, encontrar a molaridade da água é o mesmo que encontrar o número de mols de água em 1.000 g. Portanto, dividimos o peso pela massa molar para obter mols, 1.000 / 18,02 = 55,5 M.
Por que usamos a molaridade?
A molaridade é uma medida útil a ser usada quando se discute a concentração. Como a concentração tem uma grande variedade de tamanhos de unidades, de nanogramas por mililitro a toneladas por galão, é mais fácil ter uma métrica conhecida para comparação rápida de concentrações sem ter que lidar com conversões. Essa é a molaridade (M), que é o número de mols por litro.