Calculadora da Lei de Beer-Lambert
A calculadora da Lei de Beer-Lambert da Omni permite que você calcule a absorbância (ou atenuação) da luz à medida que ela passa por qualquer material. Você também pode usar esta calculadora para determinar a concentração molar de soluções. Continue lendo para saber o que é a Lei de Beer e a fórmula para os cálculos da Lei de Beer. Você também descobrirá como calcular a concentração a partir da absorbância na Lei de Beer.
O que é a Lei de Beer (Lei de Beer-Lambert)?
A também é conhecida como Lei de Beer ou Lei de Beer-Lambert-Bouguer. Ela fornece uma relação entre a concentração de uma solução e a atenuação da luz à medida que ela passa pela solução.
A Lei de Beer afirma que, quando um feixe de radiação eletromagnética passa por uma amostra (geralmente uma solução), sua absorção depende da concentração da amostra e do comprimento do caminho do feixe na amostra.
Se quiser, você pode consultar nossa calculadora de concentração para converter a molaridade de uma substância em concentração percentual.
Equação da Lei de Beer
Para entender a absorbância, vamos considerar a figura 1. Um feixe de luz de intensidade passa por uma solução colocada em um recipiente de diâmetro .
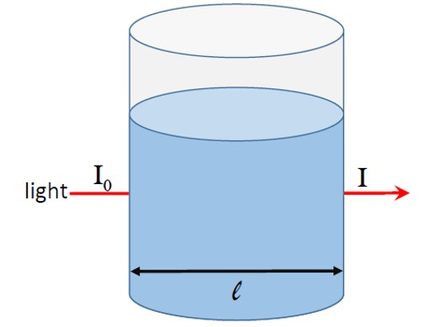
Se a solução absorver luz, a intensidade da luz que sai do recipiente será menor que . Se a intensidade da luz transmitida for , podemos definir a absorbância como:
Podemos expressar a equação da lei de Beer como:
onde:
- é o coeficiente de absorção molar ou a molaridade;
- é o comprimento do caminho do feixe na amostra; e
- é a concentração da solução.
Na espectroscopia, o comprimento do caminho é geralmente expresso em cm e a absorbância não tem unidade (uma quantidade sem dimensão). A unidade para expressar a concentração da solução da amostra é mol/L e, portanto, as unidades de absortividade molar são L/mol·cm.
Já recomendamos que você experimente a nossa calculadora de molaridade? Ela ajuda você a converter a concentração de massa de qualquer solução em uma concentração molar.
Como usar a calculadora da Lei de Beer-Lambert
Vejamos como usar a calculadora da Lei de Beer para calcular a absorbância da luz por uma solução de concentração molar . Considere que o comprimento do caminho seja , e a molaridade seja .
- Digite o valor do coeficiente de absorção molar, ou seja, .
- Digite a concentração da solução, ou seja, .
- Insira o comprimento do caminho, ou seja, .
- A calculadora exibirá a absorbância: .
- Você também pode usar essa calculadora da Lei de Beer-Lambert como uma calculadora de transmitância para absorbância. Basta inserir os valores de transmitância em porcentagem e você obterá a absorbância.
Conversão de absorbância em transmitância
Na figura 1, a fração de luz que atravessa a amostra fornece a transmitância T, ou seja, você pode ver que a luz passa por ela:
… e podemos expressar a relação entre a transmitância e a absorbância como:
Como observamos, a relação entre a absorbância e a transmitância é logarítmica. Uma absorbância de 0 implica uma transmitância de 100%.
Nas técnicas de espectrofotometria, medimos a intensidade da radiação que entra na solução da amostra e a intensidade da radiação que sai dela. Em seguida, usamos as duas intensidades para calcular os valores de transmitância ou absorbância.
Aplicações da Lei de Beer-Lambert
A maioria das técnicas de análise espectroscópica em química é baseada na Lei de Beer-Lambert. Algumas aplicações comuns da Lei de Beer em química analítica são:
- Determinar a concentração de amostras por meio da medição da absorbância.
- Determinar a identidade de uma substância desconhecida por meio da determinação de sua absortividade molar.
Temos uma ferramenta que ajuda você a calcular as proporções de duas soluções a serem misturadas para produzir uma solução necessária com uma concentração específica, a calculadora de mistura de ingredientes 🇺🇸.
Perguntas frequentes
Qual é a unidade de absorbância na Lei de Beer?
A absorbância é uma quantidade sem unidade. É a razão entre a intensidade da luz incidente e a luz transmitida; portanto, não tem dimensão nem unidades. No entanto, às vezes a absorbância é relatada em unidades de absorbância (AU).
Como calcular a absortividade molar a partir da Lei de Beer?
Para calcular a absortividade molar a partir da Lei de Beer, você deve proceder da seguinte forma:
- Multiplique o comprimento do caminho pela concentração molar da solução.
- Divida a absorbância pelo valor obtido na etapa 1.
- Parabéns! Você calculou com sucesso a absortividade molar a partir da Lei de Beer.
Como calcular a concentração a partir da absorbância na Lei de Beer?
A Lei de Beer-Lambert é frequentemente usada para determinar a concentração de soluções. Para calcular a concentração de uma solução com base na Lei de Beer, siga as instruções fornecidas:
- Determine a absorbância à medida que a luz de um determinado comprimento de onda passa pela solução.
- Descubra o comprimento do caminho que a luz tem de percorrer.
- Multiplique o coeficiente de absorção molar pelo comprimento do caminho.
- Divida a absorbância pelo valor obtido na etapa 3 e você obterá a concentração da solução.
Como calcular a transmitância a partir da absorbância?
Para calcular a transmitância a partir da absorbância, você precisa seguir as etapas indicadas:
- Subtraia o valor de absorbância do número
2. - Pegue o antilog do valor obtido na etapa 1 e você obterá a porcentagem de transmitância.
- Você também pode usar nossa calculadora da Lei de Beer-Lambert para calcular a transmitância.